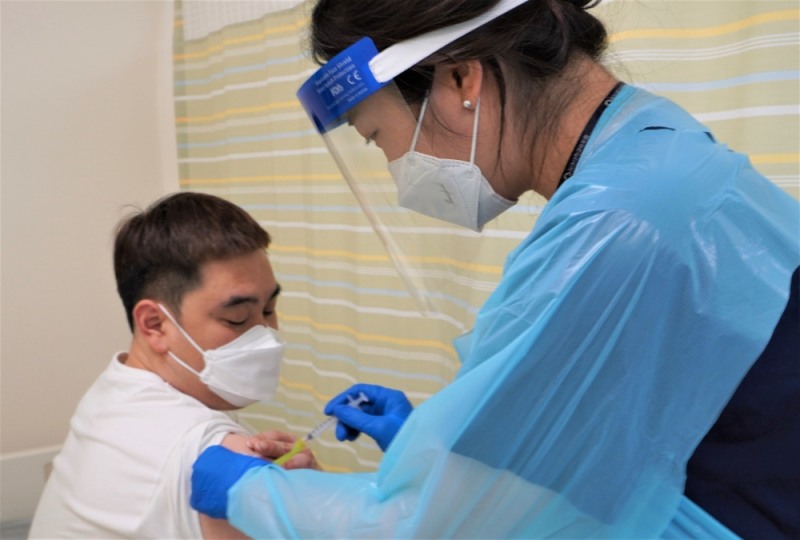
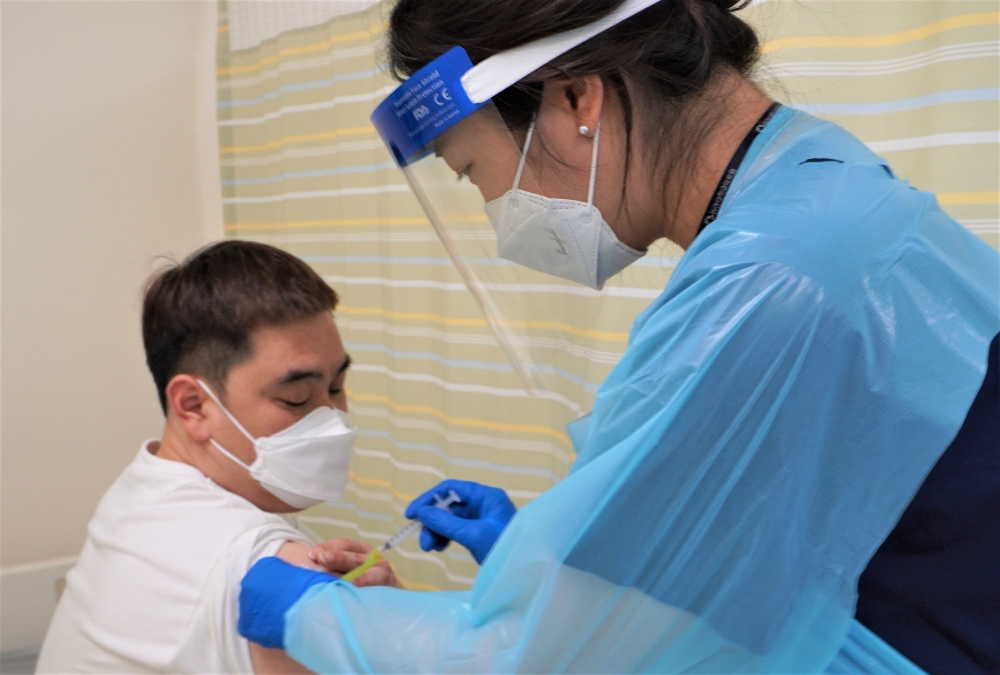
SK바이오사이언스가 개발하는 코로나19 백신의 임상3상이 본격적으로 시작됐다.
SK바이오사이언스(사장 안재용)는 미국 워싱턴대학 항원디자인연구소(Institute for Protein Design, IPD)와 공동으로 개발한 코로나19 백신 후보물질 ‘GBP510’의 임상3상 시험 첫 피험자 투여를 개시했다고 30일 밝혔다. 국내 식약처의 IND(임상시험계획) 승인 후 약 3주만으로 국내에서 개발된 코로나19 백신 후보물질의 첫 임상3상 투약이다.
첫 피험자 투여로 본격화된 GBP510의 임상3상은 향후 고려대 구로병원 등 국내 14개 기관과 유럽, 동남아 등 해외 기관에서 만 18세 이상의 국내외 성인 4,000여 명을 대상으로 진행된다. 유전자 재조합 기술로 만들어진 합성항원 백신인 GBP510을 GlaxoSmithKline(GSK)의 펜데믹 면역증강제(Adjuvant)와 혼합해 28일 간격으로 2회 근육 투여하는 방식이다.
SK바이오사이언스는 동유럽, 동남아 등 해외에서도 비영리 국제기구인 IVI(International Vaccine Institute, 국제백신연구소)와 손잡고 각 국가별 임상3상 IND(임상시험계획) 승인을 신청 중으로 빠르면 내달부터 임상에 돌입한다는 계획이다.
SK바이오사이언스는 국내외에서 진행되는 임상3상을 통해 GBP510의 면역원성 및 안전성을 평가해 내년 상반기엔 중간 데이터를 확보, 국내 보건당국의 신속 허가를 받고 WHO PQ(Pre-qualification, 사전적격성평가) 인증과 각 국가별 긴급사용허가 획득 준비 절차에도 돌입할 예정이다.
GBP510은 개발이 완료되면 수입에 의존하고 있는 국내 코로나19 백신 수급 상황의 어려움을 해소하는 단초가 될 전망이다.
SK바이오사이언스가 개발한 국산 백신인만큼 자체적으로 생산 및 공급 계획을 수립해 공급할 수 있고 장기적으로는 플랫폼 기술을 기반으로 변이 바이러스에 빠르게 대처할 수 있어 백신 주권을 확보하는 데 기여하게 된다.
또 GBP510에 적용된 합성항원 백신 플랫폼은 2∼8도의 냉장 조건에서 보관이 가능해 기존 백신 물류망을 활용해 유통할 수 있고 장기보관도 가능할 것으로 예상돼 글로벌에서도 접근성을 용이하게 확보할 수 있을 것으로 보인다.
GBP510은 CEPI가 지난해 차별화된 코로나19 백신 후보물질을 지원하고자 가동한 ‘Wave2’(차세대 코로나19 백신) 프로젝트의 최초 대상으로 선정돼 개발이 완료되면 '코백스 퍼실리티’(COVAX facility)를 통해 수억회 접종 물량이 대한민국을 포함한 전 세계에 공급될 예정이다.
SK바이오사이언스의 백신공장인 안동 L하우스는 백신 개발 즉시 연간 수억회 물량의 대규모 상업 생산을 진행하고 공장 내 9개 구역의 독립된 공간을 통해 여러 종류의 백신을 동시에 제조할 수 있는 역량을 갖췄다.
SK바이오사이언스 안재용 사장은 “보건당국과 임상기관의 신속하고 체계적인 협조 아래 성공적으로 임상3상 피험자 투여를 시작하게 됐다”며 “임상을 통해 안전성과 효과성을 철저히 검증해 대한민국 국민, 더 나아가 전 인류가 안심하고 백신을 접종할 수 있는 기반을 마련하겠다”고 말했다.
편도욱 로이슈 기자 toy1000@hanmail.net